O Complexo da Doença Respiratória Bovina (CDRB) é um enorme problema a nível mundial. Estima-se que os custos atinjam os 3 mil milhões de dólares anualmente na criação de bovinos1. Entre os agentes patogénicos implicados no complexo, o vírus respiratório sincicial bovino (BRSV) tem estado associado a 45% dos casos de CDRB2 (e 60% no caso da pneumonia enzoótica de vitelos3). Estes simples números demonstram por si só a tremenda importância do BRSV na criação de gado.

Doença aguda
Descrição geral
Os efeitos nocivos agudos de uma estirpe virulenta de BRSV a circular entre jovens vitelos podem ser evidentes. São normalmente notórios no grupo de vitelos entre 1 e 6 meses (no entanto, é de referir que a idade não é um fator protetor em si. Se o gado não tiver proteção imunológica pode morrer como consequência da infeção em qualquer idade4). Esses efeitos surgem como uma doença respiratória contagiosa grave: a morbilidade pode afetar 80% dos vitelos e a mortalidade 20%5. Na prática, até mesmo a terapêutica mais agressiva não é bem sucedida no tratamento da maior parte dos animais afetados.
Especificidade do BRSV
Este tipo de doença aguda potencialmente fatal, frequentemente observada no BRSV, é raramente observada com PI-3. No entanto, estes dois vírus induzem à necrose das células epiteliais dos bronquíolos. Desta forma, a origem das consequências letais da infeção por BRSV não pode ser encontrada no seu efeito citopatogénico direto, mas sim na agilidade do vírus em desencadear uma inflamação aguda grave em todo o órgão.
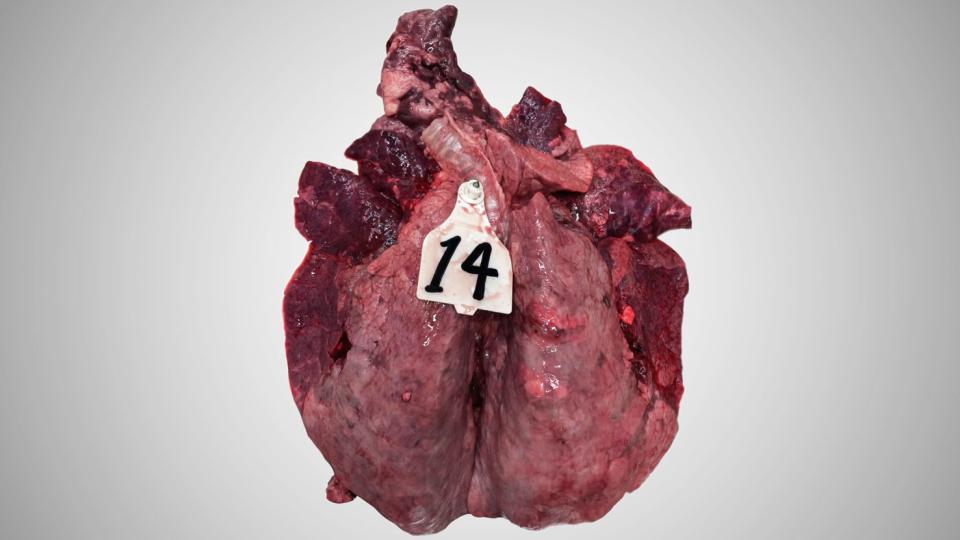
Lesões
Macroscopicamente, esta inflamação mostra as marcas de uma pneumonia broncointersticial aguda com enfisema.
Os pulmões dos vitelos que morrem após uma infeção aguda por BRSV estão extremamente congestionados. A congestão é irregular, dando um aspeto heterogéneo ao parênquima. Na maioria dos casos, a região antero-ventral dos pulmões é a que está mais congestionada e mostra algumas zonas de atelectasia. A reação dos gânglios linfáticos está sempre presente e normalmente é óbvia, uma vez que o aumento dos gânglios linfáticos pode ser 10 vezes superior ao tamanho normal. O enfisema também é característico da doença.
Os exames histopatológicos revelam uma clara lesão dos bronquíolos: necrose das células epiteliais, a presença de células sinciciais gigantes multinucleadas (que dão o seu nome ao vírus), e uma infiltração mista de neutrófilos e alguns eosinófilos (invulgar nas lesões virais clássicas). A necrose epitelial também pode envolver os pneumócitos. Como consequência, a parede alveolar está frequentemente presente na reepitelização por pneumócitos do tipo 2.
Patogenicidade
Embora ainda existam muitas questões sobre a patogenicidade da doença, a literatura focada na doença causada pelo pneumovírus (o vírus sincicial humano e bovino) indica que as piores evoluções clínicas são induzidas por uma imunorreação Th2 enviesada5. Esse tipo de reações estão próximas da hipersensibilidade tipo I e implicam a ação da IgE, dos eosinófilos e por vezes dos neutrófilos6. Nos vitelos, os neutrófilos têm um papel importante nesta patogenia7. Por isso, a razão pela qual, na mesma manada, alguns animais desencadeiam esta reação inflamatória nefasta enviesada e outros não, permanece uma pergunta difícil. A resposta depende da relação hospedeiro-agente patogénico.
• Por um lado, existem evidências de que algumas estirpes virais têm maior capacidade de provocar uma inflamação grave. Um pequeno péptido foi identificado no BRSV como sendo um dos principais agentes da reação enviesada: a viroquinina8. Foi demonstrado que consegue atrair os eosinófilos (células pivotais na reação Th2) e contrair os músculos lisos dos brônquios. Este último efeito é provavelmente a explicação para o enfisema grave que é característico das lesões pulmonares induzidas pelo BRSV.
• Por outro lado, na patogenia do BRSV, o papel do hospedeiro não é secundário. A nível de campo, os surtos clínicos de BRSV realçam a importância do hospedeiro. Aliás, ao contrário de muitos outros agentes patogénicos, que induzem as doenças mais agressivas nos animais mais fracos, o BRSV mata frequentemente os animais mais saudáveis. Nas explorações de bovinos, a título de exemplo, é frequentemente visto que os vitelos “mais bonitos” são os que morrem primeiro. Esta simples observação reflete o facto de que uma configuração especial do organismo do hospedeiro tem de estar presente para desencadear a doença e não apenas a fraqueza “clássica”.
Evolução crónica
As consequências crónicas da infeção são muito menos óbvias do que a morbilidade aguda e a mortalidade e são frequentemente subestimadas.
Consequências a médio prazo
As lesões agudas acima mencionadas refletem a ação do vírus nas células epiteliais dos bronquíolos e alvéolos. Mas, o BRSV tem também repercussões graves nas células epiteliais da traqueia. O epitélio ciliado da traqueia, juntamente com as células caliciformes, formam uma das mais eficientes defesas inatas do sistema respiratório: o transporte mucociliar. Nas condições fisiológicas, o transporte mucociliar é uma barreira mecânica que impede a colonização do trato respiratório pela Pasteurellacea, a principal família de bactérias patogénicas no gado Experiências demonstram que em vitelos saudáveis, 90% da Pasteurella multocida experimentalmente introduzida na traqueia é depurada no período de 4 horas. No entanto, outros estudos salientam que o BRSV pode reduzir a depuração mucociliar em 50%9. Nestas condições, é muito mais fácil a microflora patogénica da nasofaringe passar pela defesa. Além disso, pensa-se que a atração aumentada dos neutrófilos10 durante a infeção por BRSV vai aumentar o efeito da leucotoxina de Mannheimia haemolytica (o fator principal de virulência).
Através da sua ação prejudicial no epitélio da traqueia, o BRSV promove consideravelmente as infeções bacterianas dos pulmões.
Consequências a longo prazo
Devido ao elevado nível de exsudação e lesões no tecido, as consequências crónicas a longo prazo de uma infeção bacteriana são simples. Para infeções virais, a perspetiva normal é uma fase aguda, que pode ser fatal, seguida, no caso de sobrevivência do animal, de uma recuperação total. Este conceito não é verdade com o BRSV.
A melhor ilustração de tal é o caso descrito por Klem e colegas11. Os autores avaliaram os efeitos a longo prazo de um surto de BRSV num centro de testes de inseminação artificial. Devido aos dados zootécnicos disponíveis no centro, as consequências impercetíveis da infeção tornaram-se visíveis. Em comparação com o grupo “não clínico/não tratado”, os touros que apresentaram sintomas tiveram uma redução constante (4-10%) de peso/rácio de idade durante o período de 8 meses do estudo. Mas, mais surpreendente ainda, quando o grupo “não clínico/não tratado” foi comparado com um grupo comparável do ano seguinte, este grupo “saudável” teve um ganho diário reduzido de 111g/dia.
Este estudo demonstrou o quão prejudicial é um surto clínico de BRSV para a produtividade da manada jovem. Mesmo nos animais assintomáticos, uma estirpe virulenta de BRSV pode induzir em lesões de longo prazo que irão reduzir os rendimentos do gado.
A origem destas alterações a longo prazo é uma lesão chamada bronquiolite obliterante12. Esta é uma lesão não específica dos bronquíolos que pode ser induzida pelo BRSV num número muito elevado. Consiste em pequenos nódulos polipoides fibrosos que crescem no lúmen dos bronquíolos, causando uma grande obstrução. A consequência funcional é uma redução na eficiência das trocas gasosas nos pulmões.
Conclusão
As evidências das consequências nocivas duradouras de surtos de BRSV em animais sem tratamento (para além das perdas óbvias associadas aos vitelos que morrem da doença) são as razões pelas quais a prevenção é a única forma eficaz de lidar com este problema.
Author: Calixte Bayrou. Clinical Department of Production Animals, Faculty of Veterinary Medicine, University of Liège.
Bibliografia:
1. Watts, J. L. & Sweeney, M. T. Antimicrobial resistance in bovine respiratory disease pathogens: measures, trends, and impact on efficacy. Vet. Clin. North Am. Food Anim. Pract. 26, 79–88, table of contents (2010).
2. Brodersen, B. W. Bovine Respiratory Syncytial Virus. Vet. Clin. North Am. Food Anim. Pract. 26, 323–333 (2010).
3. Meyer, G., Deplanche, M. & Schelcher, F. Human and bovine respiratory syncytial virus vaccine research and development. Comp. Immunol. Microbiol. Infect. Dis. 31, 191–225 (2008).
4. Valarcher, J.-F. & Taylor, G. Bovine respiratory syncytial virus infection. Vet. Res. 38, 153–180 (2007).
5. Gershwin, L. J. Bovine respiratory syncytial virus infection: immunopathogenic mechanisms. Anim. Health Res. Rev. 8, 207–213 (2007).
6. Tizard, I. R. Veterinary Immunology. (Elsevier Health Sciences, 2012).
7. Hägglund, S. et al. Proteome analysis of bronchoalveolar lavage from calves infected with bovine respiratory syncytial virus—Insights in pathogenesis and perspectives for new treatments. PLOS ONE 12, e0186594 (2017).
8. Valarcher, J.-F. Bovine respiratory syncytial virus lacking the virokinin or with a mutation in furin cleavage site RA(R/K)R109 induces less pulmonary inflammation without impeding the induction of protective immunity in calves. J. Gen. Virol. 87, 1659–1667 (2006).
9. Gershwin, L. J., Gunther, R. A., Hornof, W. J. & Larson, R. F. Effect of infection with bovine respiratory syncytial virus on pulmonary clearance of an inhaled antigen in calves. Am. J. Vet. Res. 69, 416–422 (2008).
10. McGill, J. L. & Sacco, R. E. ɣ∂T cells and the immune response to respiratory syncytial virus infection. Vet. Immunol. Immunopathol. 181, 24–29 (2016).
11. Klem, T. B., Kjæstad, H. P., Kummen, E., Holen, H. & Stokstad, M. Bovine respiratory syncytial virus outbreak reduced bulls’ weight gain and feed conversion for eight months in a Norwegian beef herd. Acta Vet. Scand. 58, (2016).
12. Jubb, Kennedy & Palmer’s Pathology of Domestic Animals: Volume 2. (Elsevier, 2016). doi:10.1016/C2012-0-00823-X